شوارد قوية مقابل شوارد ضعيفة
المحتوى
- المحتويات: الفرق بين الشوارد القوية و الشوارد الضعيفة
- رسم بياني للمقارنة
- ما هو المنحل بالكهرباء القوي؟
- ما هو ضعف المنحل بالكهرباء؟
- الاختلافات الرئيسية
يُعرف الإلكتروليت القوي باسم المذاب الذي له خصائص التأين كليًا أو جزئيًا بواسطة محلول. من ناحية أخرى ، يُعرف الإلكتروليت الضعيف بأنه المذاب الذي يتميز بسمات الذوبان في محلول جزئيًا والذي يحتوي عادة على حوالي 1-10٪ من الخلط.

المحتويات: الفرق بين الشوارد القوية و الشوارد الضعيفة
- رسم بياني للمقارنة
- ما هو المنحل بالكهرباء القوي؟
- ما هو ضعف المنحل بالكهرباء؟
- الاختلافات الرئيسية
- شرح الفيديو
رسم بياني للمقارنة
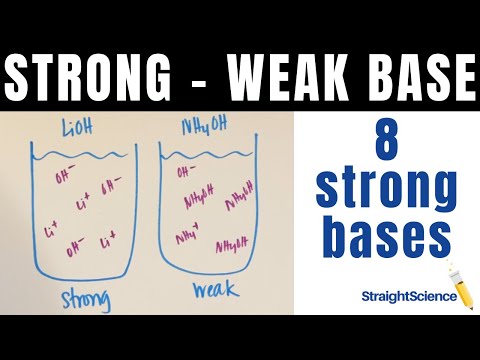
| أساس التميز | المنحل بالكهرباء قوي | ضعف المنحل بالكهرباء |
| فريف | المذاب الذي له خصائص التأين كليًا أو جزئيًا بواسطة محلول. | المذاب الذي يحتوي على ميزات الحصول على حل في حل جزئي. |
| النسبة المئوية | عادة ما يحتوي على حوالي 100 ٪ من الخلط. | عادة ما يحتوي على حوالي 1-10 ٪ من الخلط. |
| تفكك | تتم عملية التفكك لأن الأيونات هي موصلات جيدة للتيار الكهربائي في المحلول وبالتالي تساعد في المعالجة السريعة. | لا تحدث عملية التفكك بسرعات سريعة لأن الأيونات هنا لها موصلية أفضل ، لكنها ليست شوارد مناسبة للشوارد الضعيفة. |
| التوصيل | تزيد عملية التوصيل من المعدل ولكن تبقى increse خفيفة. | عملية التخفيف تزداد بمعدل سريع لا سيما بالقرب من حالة لانهائية. |
ما هو المنحل بالكهرباء القوي؟
يُعرف الإلكتروليت القوي باسم المذاب الذي له خصائص التأين كليًا أو جزئيًا بواسطة محلول. تتم عملية التفكك هذه لأن الأيونات موصلات جيدة للتيار الكهربائي في المحلول ، وبالتالي تساعد في المعالجة السريعة. الترتيب المركب لهذا المنحل بالكهرباء الصلب له وزن بخار أقل من الماء النقي عند درجة حرارة مماثلة. الأحماض الصلبة ، والقواعد الصلبة ، والأملاح الأيونية المذيبة التي ليست أحماض ضعيفة أو قواعد ضعيفة ، هي شوارد صلبة. المادة التي يتحلل محلولها المائي أو حالتها السائلة إلى جزيئات عن طريق تمرير القدرة يعرف باسم الشوارد. شوارد قوية تتأين في الماء. أنه يعني 100 ٪ من تكسر الاصطناعية في الكاتيونات والأنيونات. سواء كان الأمر كذلك ، فهذا لا يعني أن المواد الاصطناعية تتحلل تمامًا في الماء! على سبيل المثال ، هناك أنواع قليلة فقط مذيب إلى حد ما في الماء ، ومع ذلك فهي بالكهرباء الصلبة. إنه لا يعني أنه لا يتحلل بشكل خاص ، ولكن كل ذلك يذوب في تكسير الجزيئات. الرسم التوضيحي هو أساس هيدروكسيد السترونتيوم السليم ، الأب (OH) 2. إنه ذو ملاءة منخفضة في الماء ، ومع ذلك ، فإنه ينفصل تمامًا إلى جزيئات Sr2 و OH. بينما يحتوي كوب من هيدروكسيد الصوديوم (NaOH) في الماء على جزيئات Na + و OH- في الماء ، ومع ذلك لا يحتوي على NaOH حقيقي ، فإن جرة من هيدروكسيد السترونتيوم المائي تحتوي على جزيئات Sr2 + و OH- جزيئي جرامي ، Sr (OH) 2 ، وماء. على سبيل المثال ، عندما تضع تآكلًا ضعيفًا أو قاعدة ضعيفة في الترتيب ، تكون لديهم أيضًا فرصة 100٪ للفصل في الترتيب.
ما هو ضعف المنحل بالكهرباء؟
يُعرف الإلكتروليت الضعيف باسم المذاب الذي له خصائص الإذابة في محلول جزئيًا ويحتوي عادةً على حوالي 1-10٪ من الخلط. لا تحدث عملية التفكك بسرعات سريعة لأن الأيونات هنا لها موصلية أفضل ، لكنها ليست شوارد مناسبة. ستكون الإلكتروليتات الضعيفة من الإلكتروليتات التي لا تنفصل تمامًا إلى جزيئات في الترتيب وتكون في الغالب مؤينة في الترتيب (حوالي 1 إلى 10٪). فكر في المنحل بالكهرباء الضعيف كمادة محددة للغاية. عند إضافة نقطة إلى إجابة ، هناك لقطة 1-10 ٪ إما أنها سوف تنفصل تمامًا إلى جزيئاتها أو تبقى متعنتة بطرقها وليست منفصلة. عندما تنفصل ، فهذه هي الجزيئات التي يمكن أن تضيف إلى نقل شحنة كهربائية في الترتيب. بالنظر إلى شجرة عائلة الشوارد ، هناك نوعان عريضان من الشوارد الضعيفة: الأحماض والقواعد الضعيفة. تتم تسمية هذه المواد بالكهرباء الضعيفة وتعطى سلوكها مماثلة في الترتيب. على سبيل المثال ، عندما تضع تآكلًا أو قاعدة هشة في الترتيب ، يكون لديها أيضًا 1-10٪ من الفصل في الترتيب. هذا التقارب في منتصف الفصل هو الشيء الذي يجمع الأسبوع مدمرة أو قاعدة كنوع من المنحل بالكهرباء ضعيفة. من أجل الموصلية ، عندما تمر الطاقة من خلال إجابة ، افترض الماء ، فإن جزيئات المنحل بالكهرباء الضعيفة سوف تنقل هذه الشحنة ، مما يشجع الزخم الكهربائي. من الأهمية بمكان فهم العلاقة بين جودة الموصلية وتقارب جزيئات المنحل بالكهرباء العاجزة في الترتيب.
الاختلافات الرئيسية
- يُعرف الإلكتروليت القوي باسم المذاب الذي له خصائص التأين كليًا أو جزئيًا بواسطة محلول. من ناحية أخرى ، يُعرف الإلكتروليت الضعيف بأنه المذاب الذي يتميز بسمات الذوبان في محلول جزئيًا والذي يحتوي عادة على حوالي 1-10٪ من الخلط.
- ستكون الإلكتروليتات الضعيفة من الإلكتروليتات التي لا تنفصل إلى جزيئات في الترتيب وتكون في الغالب مؤينة في الترتيب (حوالي 1 إلى 10٪). من ناحية أخرى ، ستكون الإلكتروليتات القوية عبارة عن إلكتروليتات تنفصل تمامًا إلى جزيئات في الترتيب وتكون في الغالب مؤينة في الترتيب (حوالي 100٪).
- بالنسبة للكهارل القوية ، تتم عملية التفكك لأن الأيونات هي موصلات جيدة للتيار الكهربائي في المحلول ، وبالتالي تساعد في المعالجة السريعة. من ناحية أخرى ، لا تحدث عملية التفكك بسرعات سريعة لأن الأيونات هنا لها موصلية أفضل ، لكنها ليست شوارد مناسبة للشوارد الضعيفة.
- تزيد عملية التوصيل للكهارل القوي من المعدل عند حدوث التخفيف ولكن تبقى الزيادة طفيفة. من ناحية أخرى ، تزداد عملية الشرط للكهارل الضعيف بمعدل سريع أثناء التفتت وخاصة بالقرب من الحالة اللانهائية.