الذرة مقابل الجزيء

المحتوى
- المحتويات: الفرق بين الذرة والجزيء
- رسم بياني للمقارنة
- ما هي الذرة؟
- ما هو الجزيء؟
- الاختلافات الرئيسية
- شرح الفيديو
الفرق الرئيسي بين الذرة والجزيء هو أن الذرة تتكون من النيوترونات والبروتونات والإلكترونات بينما يشير الجزيء إلى مجموعة الذرات المرتبطة ببعضها البعض عبر الترابط التساهمي أو المعدني الأيوني.
المحتويات: الفرق بين الذرة والجزيء
- رسم بياني للمقارنة
- ما هي الذرة؟
- ما هو الجزيء؟
- الاختلافات الرئيسية
- شرح الفيديو
رسم بياني للمقارنة
| أساس التميز | ذرة | مركب |
| فريف | يشير Atom إلى أصغر جزء من العناصر التي تحتوي على خصائص العنصر | تشير الجزيئات إلى مجموعة الذرات أو مجموعة الذرات |
| الاعتماد | يمكن اه ويمكن لا | نعم فعلا |
| خصائص المادة | يمكن اه ويمكن لا | نعم فعلا |
| تصنيف | لا | الثاني: ذري متجانسة ذرية وغير متجانسة |
| قوة | اللبنات الأساسية للمادة | جزيئات في جسم الإنسان أكثر من النجوم في الكون |
| وجود | لا يمكن أن توجد بشكل مستقل | يمكن أن توجد بشكل مستقل |
| أمثلة | الأكسجين والهيدروجين والنيتروجين | h2 ، no ، الخ |
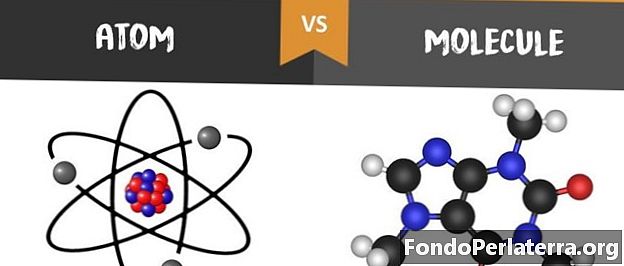
ما هي الذرة؟
يشير Atom إلى أصغر وحدة جسيم من المادة البسيطة التي لها خصائص عنصر كيميائي. تتكون جميع أنواع الغازات والمواد الصلبة والسوائل والبلازما من ذرات مؤينة أو محايدة. هذه عادةً صغيرة الحجم ولا يمكن رؤيتها من خلال العيون المجردة والمجهر المكبرة. يمكن أن يكون حجم الذرة حوالي عشرة مليارات من المتر. أنا أتحدث عن حدودهم ، ثم هذه ليست لها حدود واضحة المعالم.
مع التطور التدريجي للفيزياء ، أدرجت النماذج الذرية مبادئ الكم لشرح سلوك أفضل وتوقع من الذرة. تتكون كل ذرة من إلكترون واحد أو أكثر مرتبط بالنواة.
تتكون نواة الذرة من بروتون واحد أو أكثر وعادةً ما تحتوي على عدد مماثل من النيوترونات. وتحيط أيضًا نواة الذرة بالإلكترونات التي لها جسيمات سالبة الشحنة. يمكن شحن الذرة سالبًا أو إيجابًا اعتمادًا على غالبية الجزيئات. عندما تترابط هذه الذرات سلبًا أو إيجابًا معًا لتكوين جزيئات ، تتشكل الروابط بواسطة الإلكترونات التي تملأ المدارات الخارجية للذرات. لا يوجد ترابط في الذرة حيث توجد الذرات بشكل مستقل.

ما هو الجزيء؟
الجزيء هو أصغر جسيم من مجموعة محايدة كهربائيا تحتوي على الخواص الكيميائية لهذا المركب أو العنصر. هذه تتكون من الذرات التي عقدت معا من قبل الروابط الكيميائية. تتميز هذه الأيونات تمامًا عن الأيونات بسبب نقص الشحن الكهربائي.
تترابط ذرات معظم المواد الكيميائية بسرعة مع ذرات أخرى لتكوين جزيئات. هذه يمكن أن تختلف في الحجم والتعقيد. هذه تبقى دائما في الحركة. في السوائل والمواد الصلبة ، معبأة بإحكام معا. في الحالة الصلبة ، يمكن تشبيه حركتهم بالاهتزاز السريع. في الحالة السائلة ، تتحرك هذه بحرية فيما بينها بنوع من الانزلاق. في حالة الغاز ، تكون كثافتها أقل مقارنة بالمادة الصلبة والسائلة لنفس الرابطة الكيميائية وتتحرك بحرية أكبر مقارنة بالسائل.
بالمقارنة مع الذرة ، فإن الجزيء لديه القدرة على الوجود بذاته بسبب الإلكترون الموجود في الذرة. في الجزيء ، يمكن أن تكون الذرة مستقرة فقط في حالة توفر عدد كافٍ من الإلكترونات. وفقًا للنظرية الحركية للغازات ، "غالبًا ما يستخدم الجزيء لأي جزيء غازي بغض النظر عن تركيبته. بسبب التركيب الجزيئي أحادي الذرة ، تعتبر ذرات غاز النبيلة جزيئات. "

الاختلافات الرئيسية
- الذرة هي أصغر جسيم لعنصر بينما الجزيء هو أصغر جسيم للمركب.
- الذرة قد تكون موجودة أو غير موجودة بشكل مستقل بينما يكون الجزيء دائمًا موجودًا بشكل مستقل.
- قد تكون للذرة أو لا تحتوي على خواص مادة بينما يكون للجزيء دائمًا خصائص للمادة.
- تتكون الجزيئات من ذرة تتكون الذرة من النيوترونات والبروتونات والإلكترونات.
- قد تكون الذرة جزيءًا بسبب وجودها المستقل. توجد الذرات في جزيء أحادي الذري بسبب عوامل الثبات مثل الغازات النبيلة والهليوم ، بينما الجزيء لا يستطيع أن يقول تلك الذرة.
- ليس للذرات أنواع أخرى ، بينما للجزيئات نوعان هما جزيئات ذرية متجانسة وذرية غير متجانسة
- لا يوجد أي ترابط للذرات في حين أن الجزيئات لها قوى جزيئية وجزيئية
- يمكن رؤية ترتيب الذرات بالأشعة السينية بينما في التفاعلات ، يسمح التفاعل للإنسان بالتحرك والإحساس والتكاثر والكثير من الأشياء الأخرى.
- ثلاثة أنواع مختلفة من الذرة هي ذرة الهيدروجين ، ذرة الديوتيريوم ، والتريتيوم نوعان من الجزيء هما جزيء بسيط وجزيء معقد.
- لا يمكن أن توجد الذرة بشكل مستقل بينما يمكن أن يوجد الجزيء بشكل مستقل.
- لا يمكن أن تعيش ذرة عنصر ما في الحالة الحرة بينما يمكن أن تعيش الجزيئات في الحالة الحرة.
- لا يمكن تحديد كتلة الذرة عملياً ، في حين أن مجموع كتل الذرات الفردية يشكل كتلة الجزيء.
- يمكن للذرات الحصول على الإلكترونات وفقدانها لتشكيل أيونات ، بينما لا يمكن للجزيئات أن تكتسب أو تفقد الإلكترونات لتكوين أيونات.
- من المستحيل رؤية الذرة من خلال العين المجردة وحتى من خلال المكبرة. كما لا يمكن رؤية الجزيء من خلال العين المجردة ولكن يمكن رؤيته من خلال مجهر مكبرة للغاية.
- لا يمكن تقسيم الذرة بشكل أكبر بينما يمكن تقسيم الجزيء لإعطاء ذرات فردية.
- للذرة جاذب نووي أو رابطة معها بينما للجزيء جاذبية كيميائية أو رابطة بين الذرات.